در این مقاله به تازهترین دستاورد علمی دکتر سعید ابوئی، مقالهای با عنوان «درمان موفق زخم پای دیابتی همراه با استئومیلیت با استفاده از پلاسمای غنی از پلاکت (PRP)» که در مجله بینالمللی Current Stem Cell Research & Therapy منتشر شد، میپردازیم. در ادامه همراه ما باشید.
این پژوهش حاصل تجربهی درمان یک بیمار مبتلا به زخم پای دیابتی مقاوم به درمان بود که با استفاده از روش تزریقهای متوالی PRP طی ۱۵ هفته، بدون نیاز به قطع عضو بهبودی کامل پیدا کرد.
این مطالعه نشان میدهد که درمانهای بازساختی (Regenerative Medicine) مانند PRP میتوانند مسیر جدیدی برای درمان زخمهای مزمن و پیچیده در بیماران دیابتی باز کنند و کیفیت زندگی آنان را بهطور چشمگیری بهبود دهند.
زخم پای دیابتی چیست؟
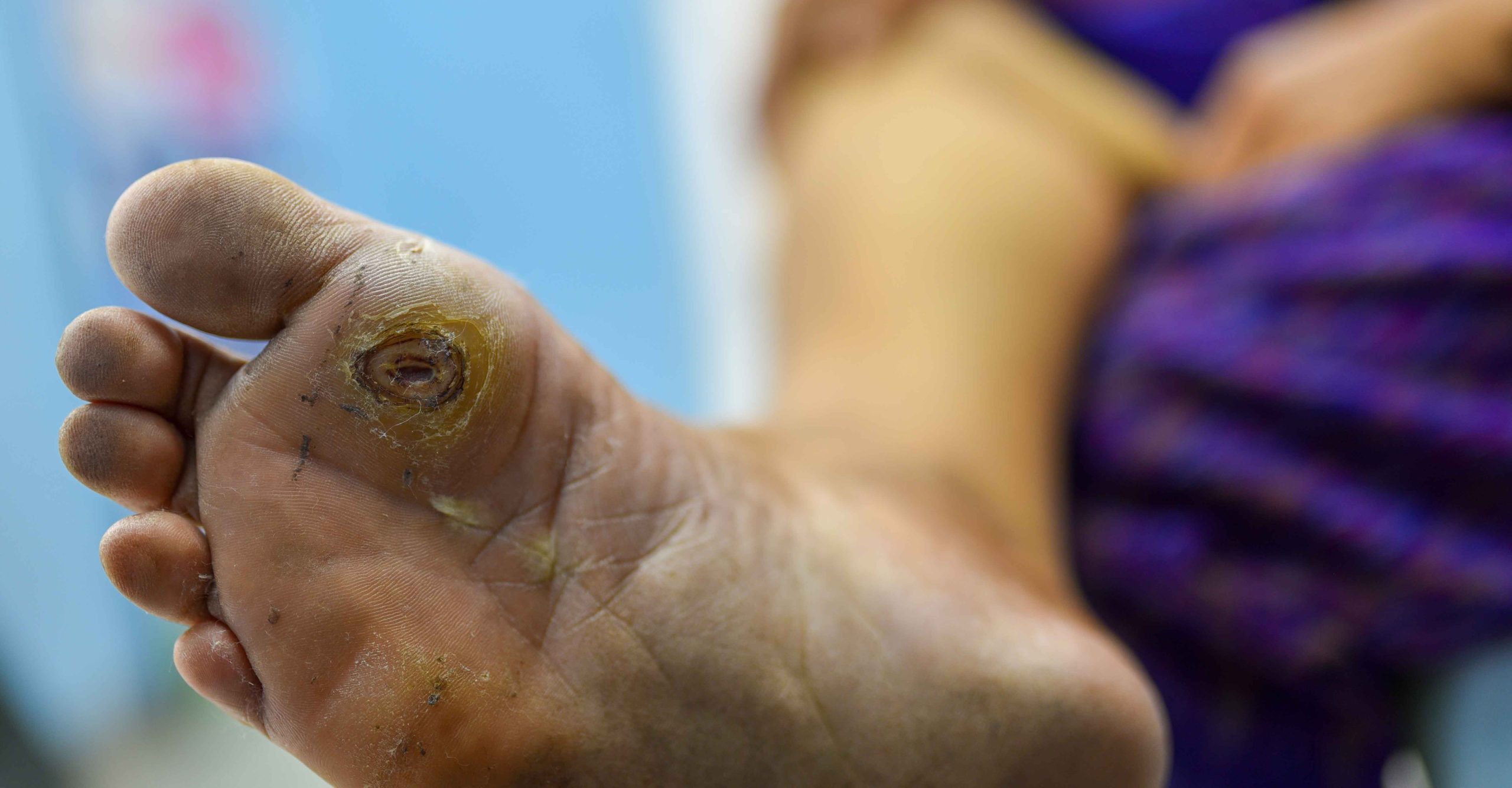
زخم پای دیابتی (Diabetic Foot Ulcer) یکی از جدیترین عوارض بیماری دیابت است.
افزایش قند خون به مرور باعث آسیب به عروق خونی و اعصاب محیطی میشود. در نتیجه، حس در پا کاهش مییابد و خونرسانی به بافتها ضعیف میشود.
در چنین شرایطی حتی یک بریدگی یا تاول ساده میتواند به زخمی عمیق تبدیل شود که به سختی ترمیم میشود. اگر درمان مناسب انجام نشود، ممکن است زخم دچار عفونت استخوانی (استئومیلیت) شود و در موارد پیشرفته، بیمار نیاز به قطع عضو پیدا کند.
استئومیلیت چیست؟
استئومیلیت (Osteomyelitis) به معنای عفونت استخوان است که معمولاً در بیماران دیابتی به دلیل زخمهای عمیق یا مزمن پا رخ میدهد.
در این وضعیت، میکروبها از طریق زخم وارد استخوان شده و باعث التهاب، تخریب و درد میشوند.
تشخیص استئومیلیت معمولاً با MRI انجام میشود و درمان آن دشوار است.
در گذشته، بسیاری از بیماران مبتلا مجبور به قطع بخشی از پا میشدند، اما امروزه روشهای نوین مانند تزریق PRP و درمانهای بازساختی امید تازهای برای درمان بدون جراحی ایجاد کردهاند.
💉 پلاسمای غنی از پلاکت (PRP) چیست و چگونه عمل میکند؟
PRP مخفف Platelet-Rich Plasma به معنای پلاسمای غنی از پلاکت است.
این روش درمانی از خون خود بیمار بهدست میآید:
ابتدا مقدار کمی از خون گرفته میشود، سپس با سانتریفیوژ، بخش پلاسمایی که سرشار از پلاکتها و فاکتورهای رشد است جدا میشود.
پلاکتها حاوی موادی هستند که به طور طبیعی روند ترمیم زخم را تحریک میکنند، از جمله:
فاکتور رشد اندوتلیال (VEGF) برای افزایش خونرسانی،
فاکتور رشد فیبروبلاستی (FGF) برای ساخت کلاژن و بازسازی پوست،
فاکتور رشد پلاکتی (PDGF) برای تحریک تقسیم سلولی و ترمیم بافت،
و پروتئینهای ضدباکتریایی که از عفونت جلوگیری میکنند.
زمانی که PRP به ناحیهی زخم تزریق میشود، این فاکتورها موجب تسریع ترمیم بافت، افزایش جریان خون، و رشد مجدد سلولهای سالم میگردند.
🧬 نتایج درمان در مطالعه دکتر سعید ابوئی
در این مطالعه، بیمار مبتلا به زخم عمیق پای دیابتی و عفونت استخوان، تحت درمان با روش ترکیبی زیر قرار گرفت:
دبریدمان منظم (برداشتن بافتهای مرده)،
استفادهی روزانه از ژل ترمیمی ComeFeel،
مصرف مکمل آمینواسید،
و تزریق هفتگی PRP به مدت ۱۵ هفته.
📈 نتیجهی نهایی:
ترمیم کامل پوست و بافت زیرین بدون نیاز به جراحی،
کاهش التهاب استخوان در MRI،
عدم وجود آبسه یا عفونت مجدد،
و بازگشت حس و عملکرد طبیعی پا.
این نتایج نشان داد که PRP نهتنها موجب ترمیم سریعتر زخم شد، بلکه به بازسازی بافت استخوانی نیز کمک کرد.
🌿 جمعبندی
پژوهش دکتر سعید ابوئی و همکاران، گامی مهم در گسترش کاربرد پزشکی بازساختی در درمان زخمهای دیابتی است.
روش پلاسمای غنی از پلاکت (PRP) میتواند به عنوان درمانی ایمن، مؤثر و کمهزینه برای بیماران مبتلا به زخمهای مزمن مورد استفاده قرار گیرد و از عوارض خطرناک مانند قطع عضو جلوگیری کند.
جهت دریافت نوبت مطب دکتر ابوئی میتوانید از اینجا اقدام نمائید.